|
Abstract. An important problem in acute intestinal obstruction and its surgical treatment is multiple organ failure, which is based on the phenomenon of "double blow" (double blow) - hyperactive response previously injured body to more aggression. Inhibition of hepatic enteral and barriers that arise in this case is important in the initiation of lung dysfunction. The incidence of pneumonia in these cases correlated with the severity of enteric disease. The lungs are the target organ, including in terms of mechanisms of bacterial translocation. The purpose of this study was to establish the particular dynamics and sequence of morphological changes in blood vessels and lung parenchyma when restoring patency of the small intestine after a preliminary modeling of low acute obstruction. In experiments on rats it was established that the pulmonary artery with intestinal obstruction respond compensatory increase resistance in the form of increased tone walls with narrowing of the lumen , which may evolve in order to maintain system pressure in response to hypovolemic , which naturally occurs in such cases. Bronchial arteries respond with an increase in throughput, which could also have a compensatory value, given the functionality of these vessels. Restoring patency of the alimentary canal after the previous 48 -hour occlusion at first does not lead to improved blood circulation in the lungs and even, on the contrary, found previously frustration deepened slightly. Dilated bronchial arteries alter reactions on spasm, which may be indicative of similar mechanisms of influence on the vascular wall of pulmonary and bronchial arteries. The reason for this may be just "double blow" - local hemodynamic and oxygen double blow in the vessels of the small intestine. Changes in the blood vessels of the lungs are secondary, and perhaps already under the influence of hemodynamic factors as well as additional toxic effects. Keywords: intestinal occlusion, reperfusion, arteries, veins, plethora, spasm, edema. Реферат. Серьезную проблему при острой кишечной непроходимости и ее хирургическом лечении составляет полиорганная недостаточность, в основе которой лежит феномен "двойного удара" ( double blow ) - гиперактивный ответ ранее травмированного организма на дополнительную агрессию. Угнетение энтерального и печеночного барьеров, возникающая при этом, имеет большое значение в инициации легочной дисфункции. Частота развития пневмоний в таких случаях коррелирует со степенью выраженности энтеральной недостаточности. Легкие становятся органом-мишенью, в том числе и в плане механизмов бактериальной транслокации.Поэтому целью данного исследования было установление особенности динамики и последовательность морфофункциональных изменений в сосудах и паренхиме легких при восстановлении проходимости тонкой кишки после предварительного моделирования ее острой низкой непроходимости. В эксперименте на крысах было установлено, что легочные артерии при кишечной непроходимости реагируют компенсаторным повышением сопротивляемости в виде повышения тонуса стенок, в ответ на гиповолемию, которая закономерно развивается в таких случаях. Бронхиальные артерии при этом реагируют увеличением пропускной способности, что также может иметь компенсаторное значение, учитывая функциональные возможности этих сосудов. Восстановление проходимости ЖКТ после его предыдущей 48-часовой окклюзии на первых порах не приводит к улучшению кровообращения в легких и даже, наоборот, ранее обнаруженные расстройства несколько усугубляются. А бронхиальные артерии изменяют дилатационную реакцию на констрикторную, что может свидетельствовать об одинаковых механизмах влияния на сосудистые стенки легочных и бронхиальных артерий. Причиной этого как раз и может быть ”doubleblow" – местный двойной, гемодинамический и кислородный удар в сосудах тонкой кишки. Изменения в сосудах легких возникают вторично и, возможно, уже под действием как гемодинамического фактора, так и в результате дополнительных токсических воздействий. Ключевые слова: кишечная непроходимость, реперфузия, артерии, вены, полнокровие, спазм, отек. |
|
Введение. Серьезную проблему в абдоминальной хирургии, как известно, составляют критические послеоперационные состояния [1, 2]. Одной из составляющих этой проблемы является полиорганная недостаточность, летальность от которой находится в диапазоне от 30 до 100% [3, 4] и не имеет тенденции к снижению. В основе возникновения полиорганной недостаточности лежит феномен "двойного удара" (double blow) - гиперактивный ответ ранее травмированного организма на дополнительную агрессию. Хотя уже даже само по себе ухудшение тканевой перфузии и гипоксия тканей так или иначе могут стать причиной развития данного синдрома [5, 6]. Ишемия-реперфузия тонкого кишечника, которая составляет основу этого феномена, как раз часто и развивается при лечении кишечной непроходимости. Угнетение энтерального и печеночного барьеров, возникающее при этом, имеет большое значение в инициации легочной дисфункции. Частота развития пневмоний в таких случаях коррелирует со степенью выраженности энтеральной недостаточности. Легкие становятся органом-мишенью, в том числе и в плане механизмов бактериальной транслокации [ 7, 8 ] . Все это дает основание считать, что профилактика развития синдрома ишемии-реперфузии и связанной с ней полиорганной недостаточности, в частности ее легочных проявлений, а также разработка и применение наиболее совершенных методов ранней диагностики и прогнозирования являются важными проблемами на современном этапе развития абдоминальной хирургии [ 9, 10 ] . Цель исследования. Установить особенности динамики и последовательность морфофункциональных изменений в сосудах и паренхиме легких при восстановлении проходимости тонкой кишки после предварительного моделирования ее острой низкой непроходимости. Материалы и методы. Эксперименты выполнены на 54 беспородных, белых, лабораторных крысах-самцах, которые были разделены на три группы: одна контрольная (6 животных) и две экспериментальных (по 24 животных в каждой). Крысам первой экспериментальной группы моделировали острую низкую обтурационную кишечную непроходимость путем перевязки тонкой кишки шелковой лигатурой на 5 см выше от места ее впадения в слепую. Для этого под внутримышечным общим кетаминовым наркозом проводили срединную лапаротомию, выводили в рану петлю кишки и через отверстие в брыжейке между аркадами последнего порядка и стенкой кишки |
проводили лигатуру, которой обходили кишку и перевязывали ее до полного перекрытия просвета. Лапаротомную рану послойно ушивали. Животным второй экспериментальной группы через 48 часов от начала эксперимента проводили релапаротомию, после чего снимали наложенную предварительно лигатуру и восстанавливали проходимость пищеварительного тракта. После операции животные находились без пищи с достаточным обеспечением водой. Из эксперимента крыс выводили путем внутриплеврального введения больших доз концентрированного тиопентала натрия. Все експерименеты проводились с соблюдением "Правил проведения работ с использованием экспериментальных животных". Для гистологического исследования вырезали кусочки легких через 12, 24 , 48 и 72 часа от начала каждой фазы эксперимента. Срезы окрашивали гематоксилином и эозином, по Вейгерту и Ван Гизон. Для проведения морфометрического анализа ветвления легочной артерии разделяли на три группы: крупные (с наружным диаметром 126-150 мкм), средние (51-125 мкм) и мелкие (26-50 мкм), для морфометрического исследования бронхиальных артерий мы избрали диапазон от 30 до 60 мкм. Подобные градации сосудистого русла встречаются и у других исследователей [ 11 , 12 ]. Морфометрическую оценку интраорганних сосудов осуществляли с помощью окуляр-микрометра МОВ-1-15 × путем определения величины наружного (d) и внутреннего (d1) диаметров. Толщину мышечного слоя (ТМ) рассчитывали по формуле [1]: |
|
|
Оценку функционального состояния сосудов проводили путем вычисления ИВ - индекса Вогенворта, т.е. отношения площади стенки артерий к площади их просвета : ИВ = ( SМ / Sпр ) 100 % , ( 2 ) где SМ - площадь медии, а Sпр - площадь просвета сосуда . Статистическую обработку полученных данных осуществляли методом вариационной статистики с использованием программы «Microsoft Excel». Определяли среднее значение (М ) и ошибку среднего ( m ). Результаты исследования и их обсуждение. По результатам кровенаполнением. Однако через 48 часов экспериментального наблюдения в отличие от легочных артерий происходила инверсия функционального состояния гладкомышечных оболочек бронхиальных артерий. Их тонус и диаметр просвета начинали постепенно восстанавливаться, приближаясь к контрольному уровню. Усиливался отек перибронхиальных пространств, нарастала их лимфо-лейкоцитарная инфильтрация (рис.1). Такие реакции артерий происходили на фоне нарастающего полнокровия легочных вен. Что касается паренхиматозных элементов, то межальвеолярные перегородки в течение всего срока наблюдения постепенно утолщались за счет капиляростазов и инфильтрации, а просвет альвеол сужался с формированием множественных зон ателектазов. Стенки бронхов при этом были окружены лимфоидными муфтами. Восстановление проходимости ЖКТ после его предыдущей 48 - часовой окклюзии на первых порах не приводило к улучшению кровообращения в кровеносном русле легких и восстановления состояния паренхимы. Наоборот, предварительно обнаруженые расстройства даже несколько усугублялись, что подтверждалось, в частности, своеобразием сосудистых реакций. Уже через 12 часов после восстановления проходимости тонкой кишки это проявлялось усилением спастических реакций в артериях и артериолах с последующим резким снижением их пропускной способности за счет прогрессирующего сужения просвета. Продолжал нарастать тонус ветвей легочных артерий, восстанавливался и значительно вырастал тонус бронхиальных артерий. Об этом свидетельствовало не только утолщение стенок сосудов и сужение их просвета, но и резкое усиление складчатости до «гофрованости» их внутренних эластических мембран. Более интенсивным становилось полнокровие легочных вен. Особенно это заметно было в венах мелкого калибра, которые были «нафаршированы» форменными элементами крови. Межальвеолярные перегородки значительно утолщались за счет гидратации и инфильтрации. В просвете альвеол нередко выявлялся десквамированый эпителий и скопления эритроцитов (рис. 2). Мелкие бронхи были спазмированными о чем свидетельствовала складчатость их слизистой оболочки. В просвете бронхов нередко визуализировалисьскопления слизи, десквамированного эпителия и эритроцитов ( рис. 3). Аналогичные явления наблюдались и Однако реперфузия тонкой кишки вызвала в бронхиальных сосудах уже констрикторные реакции аналогично легочным артериям, что может быть результатом одинакового механизма их развития. Через 24 часа реперфузионного периода индекс Вогенворта в бронхиальных артериях уже превышалконтрольные цифры на 29%.
|
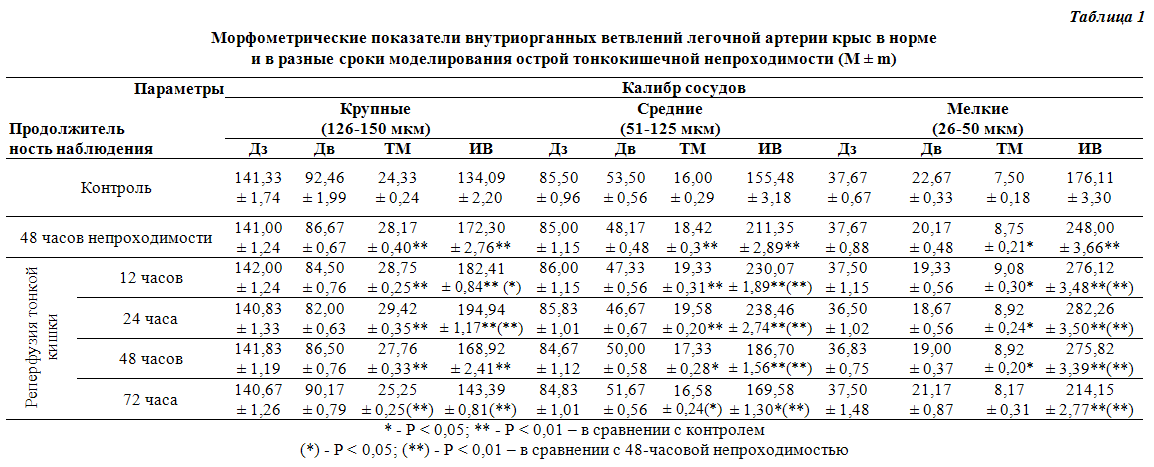
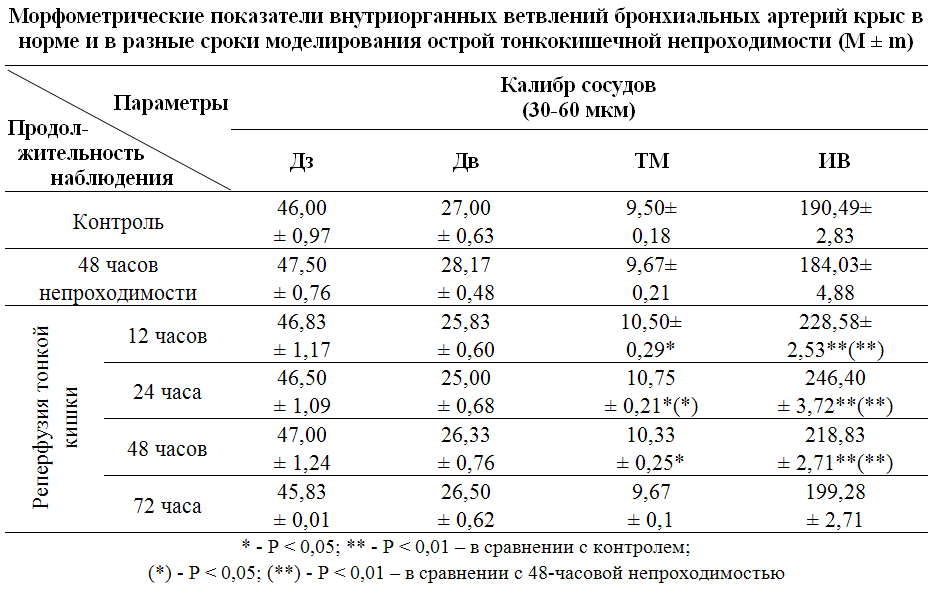
экспериментального исследования было установлено, что при моделировании острой низкой тонкокишечной непроходимости в кровеносных сосудистых руслах и паренхиме легких происходили весьма ощутимые процессы структурной реорганизации. Вследствие повышения тонуса и гипертрофии гладкомышечных оболочек легочных артерий различных уровней ветвления их стенки постепенно утолщались, а просвет сужался. Интенсивность этого процесса нарастала с уменьшением калибра сосудов. Бронхиальные артерии, наоборот, сначала реагировали расширением просветов и усиленным через 24 часа реперфузионного периода. Кроме того, в данный период эксперимента можно было наблюдать усиление некоторых компенсаторно-приспособительных реакций легочных сосудов. Значительно чаще чем в норме можно было выявить наличие и раскрытие артерио-венозных анатосмозов, благодаря которым кровь обходила гемомикроциркуляторное русло, уменьшая тем самым гемодинамическую нагрузку на него при нестабильности бронхиального притока (рис. 4). Увеличение кровенаполнения вен при этом вызывало у них реакции усиления гемодинамического сопротивления, которые проявлялись повышением тонуса гладкомышечных сфинктеров при впадении вен меньшего калибра в более крупные коллекторы следующих порядков ( рис. 5). Начиная с 48-часового и продолжаясь в следующем сроке наблюдения характерным было постепенное восстановление легочного и бронхиального кровообращения с нормализацией структурной организации паренхиматозных элементов. Частично снижался тонус бронхов и сосудов, уменьшались явления полнокровия, спадал отек и инфильтрация межальвеолярных перегородок с уменьшением их толщины ( рис. 6 ). Однако даже через 72 часа с момента реперфузии тонкой кишки в легких еще продолжали обнаруживаться остаточные явления описанных выше патологических изменений, причем в стенках альвеол, периваскулярных и перибронхиальных пространствах они нередко трансформировались в склеротические изменения с разрастанием соединительной ткани. Описанные изменения, которые были обнаружены на светооптическом уровне имели свое объективное морфометрическое подтверждения (табл. 1). Если после 48-часовой кишечной непроходимости индекс Вогенворта в легочных ветвлениях превышал контрольные цифры на 28-36-41 % в артериях крупного, среднего и мелкого калибров соответственно, то после реперфузии тонкой кишки этот показатель продолжал и дальше постепенно нарастать, превосходя контрольный уровень к 24 часам реперфузионного наблюдения уже на 45-53-60 % в соответствии с выбранной градацией сосудов. Относительно бронхиальных артерий, то при моделировании кишечной непроходимости их дилатационная реакция подтверждалась снижением уровня индекса Вогенворта на 4 % по сравнению с контролем. |
|
Через 48 часов и до 72 часов реперфузионного мониторинга наблюдалось некоторое возвращение морфометрических показателей к контрольному уровню, хотя полного восстановления так и не наступало. Препятствием к этому могли быть склеротические изменения, которые успевали на это время развиваться в интерстиции, а также в паравазальных и перибронхиальных зонах. Таким образом, полученные в процессе исследования результаты свидетельствуют о том, что легочные артерии при кишечной непроходимости реагируют компенсаторным повышением сопротивляемости в виде повышения тонуса стенок и сужением просвета, которые могут развиваться с целью поддержания системного давления в ответ на гиповолемию, которая закономерно развивается в таких случаях [13]. Бронхиальные артерии при этом реагируют увеличением пропускной способности, что также может иметь компенсаторное значение, учитывая функциональные возможности этих сосудов [1] . Восстановление проходимости ЖКТ после его предыдущей 48 -часовой окклюзии на первых порах не приводит к улучшению кровообращения в легких и даже, наоборот, обнаруженные предварительно расстройства несколько усугубляются. При этом бронхиальные артерии меняют дилатационную действует на легочные артерии - местного двойного гемодинамического и кислородного удара с усугублением гипоксии и развитием склеротических изменений, что препятствует в отдаленном периоде полному восстановлению структурной организации паренхимы и кровеносного русла легких. Перспективы дальнейших исследований. Изучение морфофункцирнальних |
реакцию на констрикторную, что может быть свидетельством одинаковых механизмов влияния как на сосудистые стенки легочных, так и бронхиальных артерий. Причиной этого может быть " double blow " - местный двойной гемодинамический и кислородный удар в сосудах тонкой кишки. Изменения в сосудах легких возникают вторично, и возможно уже под действием как гемодинамического фактора, так и дополнительных токсических воздействий [15]. Выводы 1. При прогрессировании кишечной непроходимости легочные артерии реагируют снижением пропускной способности в виде утолщения стенок и сужения просвета, может быть реакцией на гиповолемию, которая закономерно развивается в таких случаях. 2. Бронхиальные артерии при этом наоборот, расширяясь, создают условия для компенсаторного улучшения кровоснабжения легких. 3. Восстановление проходимости ЖКТ после его предыдущей окклюзии на первых порах не приводит к улучшению кровообращения в легочных сосудах, а выявленные предварительно расстройства, напротив, несколько усугубляются. 4. Бронхиальные артерии при этом также изменяют дилатационные реакции на констрикторные, что может быть результатом влияния одного и того же механизма, который особенностей перестройки кровеносного русла легких при реперфузии тонкой кишки после предварительно смоделированной ее острой непроходимостью может быть основой для разработки и обоснования способов предупреждения развития реперфузионного синдрома. |
|
|
|
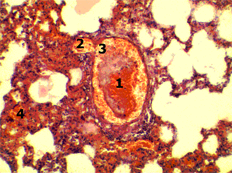
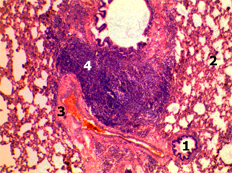
Утолщение стенки бронхиальной артерии - 1; лимфоидная инфильтрация пербронхиальной локализации - 2, отек стенки бронха - 3. Рис. 1. Гистологический срез стенки бронха крысы через 48 часов от начала моделирования острой низкой тонкокишечной непроходимости. Окраска гематоксилином и эозином. х 240. |
|
|
|
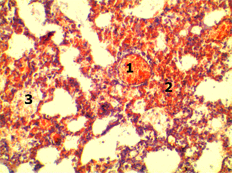
Полнокровие мелкой ветви легочной вены - 1; пердиапедезные кровоизлияния в просвет альвеол - 2; десквамация альвеолярного эпителия - 3. Рис. 2. Гистологический срез легкого крысы через 12 часов от начала реперфузии тонкой кишки после предварительного 48-часового моделирования ее острой низкой непроходимости. Окраска гематоксилином и эозином. х 240. |
|
|
|
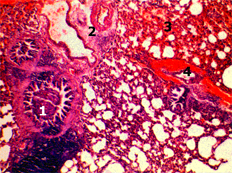
Десквамированый эпителий и слизь в просвете спазмированного бронха - 1, усиление тонуса гладкомышечной оболочки бронхиальной артерии - 2; инфильтрация и кровоизлияния в межальвеолярные перегородки - 3; полнокровие вен - 4. Рис. 3. Гистологический срез легкого крысы через 12 часов от начала реперфузии тонкой кишки после предварительного 48-часового моделирования ее острой низкой непроходимости. Окраска гематоксилином и эозином. х 180. |
|
|
|
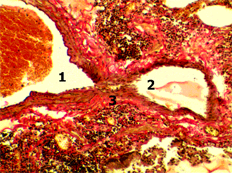
Просвет ветви легочной артерии - 1; просвет ветви легочной вены - 2; артерио-венозное соустье - 3. Рис. 4. Гистологический срез легкого крысы через 24 часа от начала реперфузии тонкой кишки после предварительного 48-часового моделирования ее острой низкой непроходимости. Окраска гематоксилином и эозином. х 240.
|
|
|
|
Просвет вен различных калибров, заполненный форменными элементами крови - 1, 2; гладкомышечный сфинктер при впадении меньшей по калибру вены в коллектор следующего порядка - 3. Рис. 5. Гистологический срез легкого крысы через 24 часа от начала реперфузии тонкой кишки после предварительного 48-часового моделирования ее острой низкой непроходимости. Окраска гематоксилином и эозином. х 240.
|
|
|
|
Незначительное усиление тонуса стенки бронха малого калибра - 1, уменьшение инфильтрации и толщины межальвеолярных перегородок - 2; умеренное полнокровие и неравномерность толщины стенки бронхиальной артерии - 3; перибронхиальная лімфо-лейкоцитарная инфильтрация - 4. Рис. 6. Гистологический срез легкого крысы через 48 часов от начала реперфузии тонкой кишки после предварительного 48-часового моделирования ее острой низкой непроходимости. Окраска гематоксилином и эозином. х 180.
|