|
Резюме. Исследование проведено на адаптированных к внеклеточному обезвоживанию белых лабораторных крысах-самцах с различным типом автономной нервной системы. Изучали содержание в плечевых костях экспериментальных животных некоторых неорганических макро- и микроэлементов а также динамику их содержания при тяжелом внеклеточном обезвоживании и в период реадаптации 1, 3 и 6 недель. Установлено, что количественные характеристики состава макро- и микроэлементов в костной ткани экспериментальных животных зависят от типа их автономной нервной системы. Доказано, что костная ткань плечевых костей белых лабораторных крыс с парасимпатотоническим типом АНС характеризуются большей резистентностью к воздействию обезвоживающего фактора и сохранением регенерационных свойств, что проявляется лучшими показателями восстановления в реадаптационный период. Ключевые слова: внеклеточное обезвоживание, костная ткань, макро- и микроэлементный состав.
Реферат. Исследована динамика интенсивности липопероксидации в тканях печени, легких и сердца в условиях тяжелой механической травмы. Показано, что содержание малонового диальдегида существенно превышает уровень интактных животных до 28 суток эксперимента. При этом его динамика носит колебательный характер с достижением максимума через 7 суток после травмы, периодом снижение - через 14 суток, повторным, но меньшим по амплитуде повышением через 21 сутки и снижением через 28 суток. Во все сроки наблюдения интенсивность липопероксидации в целом больше в ткани печени и меньше в ткани легких. Аbstract.The dynamics of the intensity of lipid peroxidation in the liver, lung and heart under severe mechanical trauma were investigated. It is shown that by 28 days of the experiment the malonic dialdehyde content significantly exceeds its level in intact animals. While its dynamics is oscillatory with the achievement of maximum at 7 day after injury, a period of decline - at 14 days, repetitive, but a smaller increase in amplitude at 21 day and decreased after 28 days . During all period of observation in the intensity of lipoperoxidation in general was more than liver and lung tissue |
|
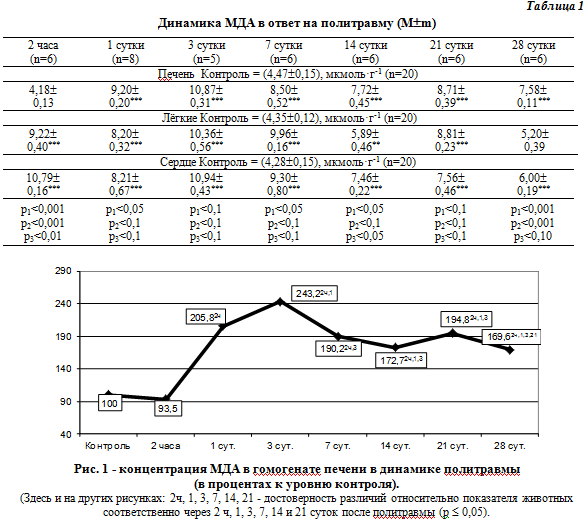
Актуальность. Одним из ведущих патогенетических механизмов тяжелой травмы является интенсификация перекисного оксиления липидов (ПОЛ) [1]. Установлено, что наибольшая интенсификация ПОЛ наступает в период максимальных проявлений системного ответа организма на воспаление и возникает не только в зоне действия повреждающего фактора, но и в отдаленных органах и тканях [2]. Ранее нами была предложена модель политравмы [3], которая включает повреждение бедренной кости, внешнее кровотечение с введением аутокрови в брюшную полость, однако состояние ПОЛ в тканях печени, легких и сердца как системное проявление воспалительного ответа не было исследовано, что стало целью нашего исследования. Материал и методы. Эксперименты проведены на 62 нелинейных белых крысах-самцах массой 180-200 г, которые содержались на стандартном рационе вивария. Политравму выполняли по методике Козак Д. В. (2011) [3] в условиях тиопентал-натриевого наркоза (40 мг × кг-1). Из эксперимента животных выводили после наркотизации путем тотального кровопускания из сердца через 2 ч, на 1, 3, 7, 14, 21 и 28 суток после травмы. У животных, которые выжили, состояние ПОЛ оценивали по содержанию в сыворотке крови малоновго диальдегида (МДА) [4]. Полученные цифровые данные подвергали статистическому анализу с использованием программы STATISTICA 10.0 ("StatSoft, Inc.", США). Результаты и их обсуждение. Как видно из табл. 1, рис. 1, через 2 часа посттравматического периода содержание ТБК-активных продуктов ПОЛ в ткани печени практически не изменялось и статистически достоверно не отличалось от уровня контроля. В дальнейшем этот показатель рос и через 1 сутки становился в 2,05 раза (р <0,001) больше, чем в контрольной группе. Через 3 суток данный показатель достигал максимума и в 2,43 раза превышал относительно предыдущего срока наблюдения (р < 0,05), однако через 3 суток вновь повы |
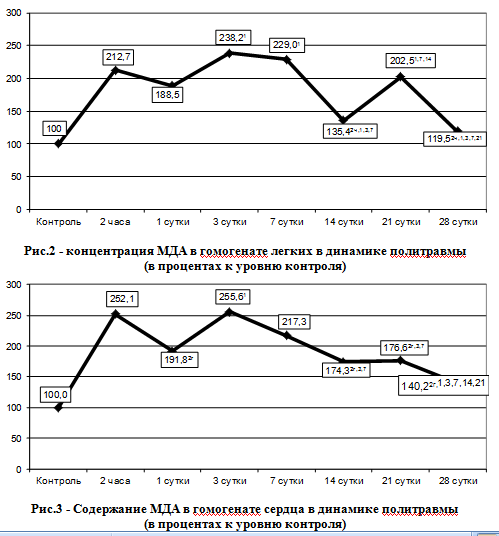
контрольный уровень (р <0,001), а также на 18,2% предыдущий срок наблюдения (р ≤ 0,05). Через 7 суток содержание в гомогенате печени ТБК-активных продуктов ПОЛ снижался (на 21,8% по отношению к предыдущему сроку наблюдения, р ≤ 0,05) и через 14 суток достигал минимального уровня. Однако по сравнению с контрольной группой в эти сроки наблюдения данный показатель оказался существенно больше (соответственно в 1,90 и 1,73 раза, р ≤ 0,05). Через 14 суток наступал повторный эпизод интенсификации ПОЛ в ткани печени: содержание ТБК-активных продуктов увеличивался относительно предыдущего срока наблюдения на 12,8% (р ≤ 0,05) и в 1,95 раза превышал уровень контроля (р <0,001). Через 28 суток исследуемый показатель снова статистически достоверно снижался - на 13,0% (р ≤ 0,05) и превышал контроль в 1,70 раза (р <0,001). Как видно из табл. 1, рис.1 уже через 2 часа после моделирования политравмы наблюдалось статистически достоверное по контрольной группы повышение содержания в тканях легких ТБК - активных продуктов ПОЛ (в 2,12 раза, р < 0,001 ). В дальнейшем до 3 суток этот показатель увеличивался, до 14 суток - существенно снижался относительно предыдущих сроков наблюдения, однако он продолжал быть на 34,71 % больше, чем в контроле ( р < 0,01 ) . Через 21 сутки наблюдалось повторное повышение содержания ТБК- активных продуктов ПОЛ в ткани легких (на 49,58 % относительно предыдущего срока наблюдения, р ≤ 0,05) с последующим наиболее выраженным снижением через 28 суток. Исследуемый показатель практически не отличался от контрольной группы. Как видно из табл. 1, рис.3, после моделируемой скелетной травмы, по сравнению с контрольной группой, содержание ТБК- активных продуктов ПОЛ в ткани миокарда было статистически достоверно больше во все сроки наблюдения ( р < 0,001 ). Через 2 часа он резко возрастал и в 2,5 раза превысил уровень контроля ( р < 0,001 ), через 1 сутки он снижался и был достоверно меньше шался достигая максимального отклонения от контрольного уровня. |
|
В дальнейшем до 14 суток исследуемый показатель снижался и достигал 174,3 % контрольной группы. Через 28 суток отмечалось его последующее уменьшение до уровня 140,2 % контрольной группы. Сравнение содержания МДА в исследуемых органах в динамике политравмы было установлено, что через 2 ч. содержание МДА в печени практически не менялось, в то время, как в легких и сердце возрастало более чем в 2 раза (р1 -2 < 0,001). В дальнейшем через 1 сутки, наоборот величина данного показателя в ткани печени стала выше, чем в легких (на 12, 2 % , р1 < 0,05). Через 3 суток, когда показатель во всех органах достигал максимума различий в его величине не отмечалось (р1 -3> 0,05). В дальнейшем до 14 суток показатель в исследуемых тканях снижался таким образом, и в печени и в сердце существенно превышал аналогичный уровень в легких (соответственно на 31,0 и 26,6 % , р1 < 0,05 , р3 < 0,05) . централизацией кровообращения в условиях шока, углубляет гипоксию и четко наблюдается видно через 1 сутки после травмы. Малейшие нарушения процессов ПОЛ отмечаются в ткани легких. Несмотря на развитие острого поражения, которое имеет место практически при любой тяжелой травме [6], ткань легких все же находилась в выигрышном положении с точки зрения поступления кислорода. Таким образом, в активации липопероксидации на фоне моделируемой травмы отмечаются общие закономерности, которые указывают на глубокие системные отклонения, что следует учитывать при разработ |
контрольный уровень (р <0,001), а также на 18,2% предыдущий срок наблюдения (р ≤ 0,05). Через 21 день, когда отмечалось повторное повышение МДА его величина в органах существенно не отличалась. Через 28 суток, когда наступало восстановление показателей жизнедеятельности у подопытных животных, содержание МДА снижался. Однако был менее уровня контроля и по величине распределился следующим образом: печень - сердце - легкие. Таким образом, в ответ на тяжелую травму отмечается существенный рост интенсивности липопероксидации в ткани печени, легких и сердца в течение всего срока наблюдения. Данный результат можно расценить как проявление системных отклонений под влиянием травмы. Во всех органах содержание МДА увеличивался до 3-7 суток, в дальнейшем снижался до 14 суток, повторно, но с меньшей амплитудой рос через 21 сутки и снижался через 28 суток. Подобное колебания этого показателя было выявлено в сыворотке крови [5]. В целом наиболее интенсивно ПОЛ росло в ткани печени, что, очевидно, связано с одновременной поставкой артериальной и венозной кровью и разработке патогенетически обоснованных методов коррекции. Выводы. 1. Под влиянием тяжелой травмы в тканях печени, легких и сердца существенно возрастает содержание МДА, динамика которого носит колебательный характер с достижением максимума через 7 суток после травмы, периодом снижение - через 14 суток, повторным, но меньшим за амплитудой повышением через 21 сутки и снижением через 28 суток. 2. Во все сроки наблюдения интенсивность липопероксидации в органах существенно превышает уровень контроля и в целом больше в ткани печени и меньше - в ткани легких. |
|
Литература 1.. Петухова О. В. Содержание липопротеидов и продуктов перекисного окисления липидов у больных в остром периоде политравмы / О. В. Петухова, И. М. Устьянцева, В. В. Агаджанян // Политравма. – 2006. – № 3. – С. 65–68. 2. Генинг Т. П. Показатели перекисного окисления липидов и антиоксидантной защиты в системе "сыворотка крови – эритроцит” при острой циркуляторной гипоксии / Т. П. Генинг, Д. А. Ксейко // Успехи современного естествознания. – 2004. – № 4. – С. 17–20. 3. Пат. 63997 Україна, МПК G 09 В 23/28. Спосіб моделювання політравми / Козак Д.В.; заявник і патентовласник Тернопільський державний медичний університет імені І.Я. Горбачевського. – № u 201104110 ; заявл. 05.04.11 ; опубл. 25.10.11, Бюл. 20. 4. Андреева Л. И., Кожемякин Л. А., Кишкун А. А. Модификация метода определения перекисей липидов в тесте с тиобарбитуровой кислотой // Лаб. дело. – 1988. – № 11. – С. 41-43. 5. Іванюшко О.В. Особливості клініко-біохімічних порушень при ізольованій та поєднаній ЧМТ / О.В.Іванюшко // Біль, знеболювання і інтенсивна терапія. – 2008. – №2. – С.39-46. 6. Ельский В. Н. Избранные аспекты патогенеза и лечения травматической болезни / Ельский В. Н., Климовицкий В. Г., Золотухин С. Е. [и др.] – Донецк: ООО "Лебедь”, 2002. – 360 с. |





